
« Be water my friend » – Bruce Lee
4 mai 2023
La mémoire de l’eau : l’enjeu d’une suspension d’incrédulité
28 septembre 2023
L’eau dans tous ses états
Les aspects scientifiques méconnus de l’eau

« Nos connaissances sont une goutte d’eau, notre ignorance, un océan ».
Cette formule du célèbre scientifique du XVIIe siècle Isaac Newton (qui fut mathématicien, physicien, philosophe, astronome et théologien) est encore d’actualités de nos jours et s’applique en particulier, par un effet de mise en abîme ironique de sa propre analogie, à l’eau elle-même.
Pourtant, affirmer que l’eau – cette matière si communément répandue – demeure une énigme peut surtout s’apparenter à une provocation. En effet, tout semble avoir été révélé à son sujet depuis que sa formule chimique H2O a été formalisée au début du XIXe siècle :
- tant ses différents aspects possibles (liquide, gazeux, solide)
- que son rôle fondamental pour l’apparition et le maintien de la vie biologique
Et pourtant, il existe encore aujourd’hui des congrès de spécialistes sur cette matière – réunissant chimistes et physiciens – qui continuent d’explorer les propriétés fascinantes de cette molécule en apparence si simple. Et ces experts n’hésitent pas à en parler comme d’une « aqua incognita » – une réalité dont la complexité maintient ouvertes de nombreuses questions irrésolues qui appellent à des modélisations toujours plus avancées.
Aussi, on n’explorera dans cet article ni le savoir qui est répété à peu près partout au sujet de l’eau (ses différentes phases et l’importance de l’hydratation, tant il serait redondant de reproduire à nouveau une telle description) ni les aspects sur lesquels les spécialistes s’interrogent (en raison de la technicité aride qu’ils mobilisent), mais – entre ces deux pôles – les aspects de l’eau que l’on ne connaît que trop peu.

L’enjeu est de témoigner de l’incroyable richesse que dissimule la simplicité du mot « eau » et de montrer, à rebours de notre regard qui ne s’étonne plus de ses propriétés, qu’elle est une matière qui est tout sauf banale, afin de renouveler notre capacité à regarder le monde avec émerveillement.
1 Seulement trois états de l’eau ?
On aime à répéter que le corps humain est en moyenne composé à 65% d’eau. C’est en effet l’un des arguments les plus fréquemment utilisés pour souligner l’importance d’une bonne hydratation.
Or, s’il faut répéter cette information, c’est précisément parce que nous n’éprouvons pas notre corporalité comme un contenant rempli à 65% de liquide : nous nous sentons surtout solides – constitués d’os et de muscles essentiellement.
Il y a une raison fondamentale à cela : c’est que l’eau dans toute cellule, qui représente 70% de son poids moyen quelle que soit la cellule considérée, ne se comporte pas comme un liquide. Les seuls lieux du corps où l’eau se comporte comme un liquide sont le sang et la lymphe.
C’est pourtant une erreur que commet la biologie et qui explique pourquoi l’eau a si peu d’importance dans ses manuels et articles scientifiques, en comparaison des protéines ou des enzymes.
L’eau n’a donc pas seulement 3 états possibles, mais au moins 4. Ce dernier, que le chimiste Marc Henry nomme « eau morphogénique », concerne le comportement de l’eau à l’échelle nanoscopique quand elle hydrate les différentes organites d’une cellule – ce qui la rend invisible au microscope.
De fait, une photographie d’une cellule ne montre qu’une structure compacte sans vide : il faut donc loger l’eau dans une gaine de molécules de 4 couches maximales (1,2 nanomètres d’épaisseur) qui hydrate chaque organite et chaque protéine qui s’y trouve.
Dans cette configuration, l’eau se comporte comme un gel, une matière avec des propriétés intermédiaires entre celle de l’eau liquide et de la glace, comme l’attestent les études qui ont été réalisées à ce sujet et que l’on peut pour une part (sans prétendre à l’exhaustivité) répertorier pour souligner la spécificité de l’eau morphogénique.

On remarque que l’eau morphogénique surpasse par ses propriétés certaines qualités de la glace et surtout celles de l’eau liquide, ce qui en fait une matière exceptionnelle. Une analyse qui rend cependant cohérente la relation entre le poids de l’eau dans toutes les cellules et le fait qu’elles peuvent fabriquer des structures aussi résistantes que des os ou des tendons, ainsi que la pression formidable que les végétaux peuvent exercer pour grandir jusqu’à vaincre le bitume.

2 Une unique identité moléculaire ?
Parler scientifiquement de l’eau, c’est parler surtout des propriétés de la molécule d’eau que la chimie a pu isoler : la fameuse formule H2O qui sert aujourd’hui à identifier cette matière. En réalité, si cette formule est exacte, elle ne recouvre pas toute la complexité des visages moléculaires que l’eau peut adopter ; si bien qu’elle n’est qu’une approximation chimique héritée d’expériences de grande imprécision utilisant des volumes importants.
Avec les outils d’analyse actuels, si l’on souhaite faire preuve de précision scientifique, il faudrait parler des nombreuses identités chimiques de l’eau dont H2O n’est que la forme la plus répandue et la plus simple : soit pas moins de 25 formules différentes, liées aux variantes introduites par l’existence d’ions et surtout d’isotopes – lesquels désignent des entités atomiques dont les noyaux contiennent un nombre différent de neutrons.
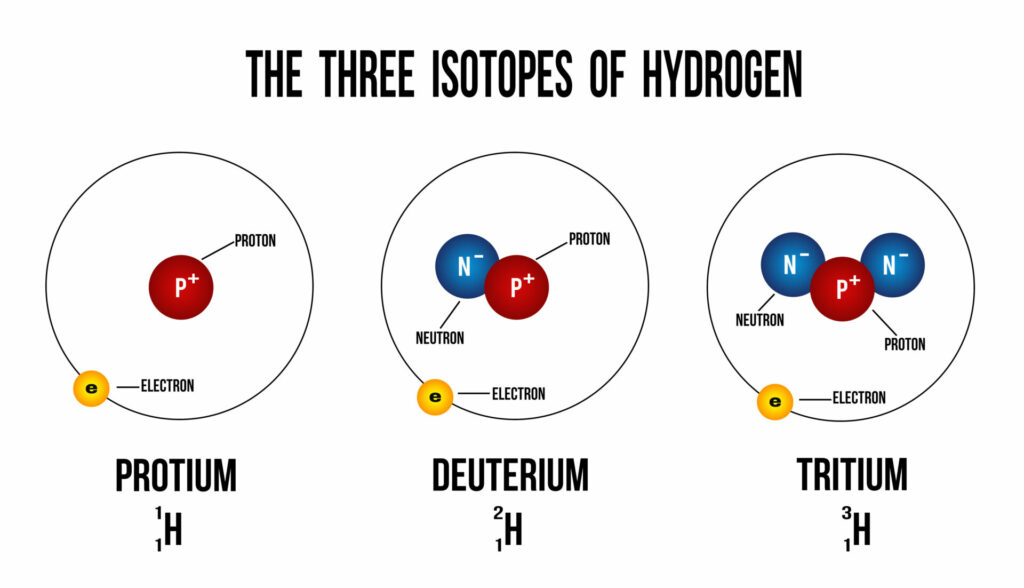

Ainsi, il existe un grand nombre de molécules d’eau distinctes possibles si l’on tient compte du fait que la formule H2O peut s’écrire :
- tant avec l’atome d’hydrogène classique qu’avec ses isotopes (le deutérium et le tritium)
- mais aussi tant avec l’atome d’oxygène classique qu’avec ses isotopes (le monoxyde 17 et le monoxyde 18).
C’est l’ensemble de toutes les combinaisons possibles qui expliquent la poly-identité de l’eau.
En particulier, certaines sont des formes radioactives : en particulier l’eau « mi-tritiée » (avec un isotope tritium), lourde ou non (avec deutérium), et l’eau « tritiée » (avec deux isotopes tritium).
Certaines de ces formes s’avèrent particulièrement rares dans l’univers, au point qu’on ne compte pour certaines d’entre elles, comme l’eau mi-lourde 17 et l’eau mi-lourde 18, que quelques dizaines d’éléments sur un milliard, voire pour l’eau lourde 17 et l’eau lourde 18 juste quelques traces.
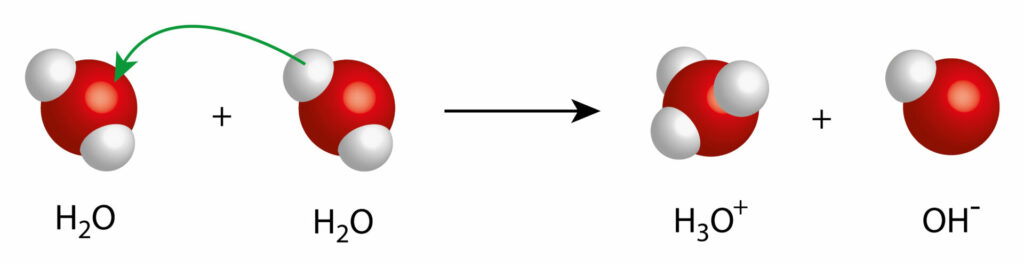
À cela s’ajoute l’existence de formes ioniques de la molécule d’eau, qui peuvent influencer l’orientation de son pH. Car l’eau liquide n’est pas une structure où les molécules sont figées ; celles-ci peuvent changer de structure de façon labile selon le principe de l’autoprotolyse.
Selon ce principe, deux molécules H2O peuvent spontanément donner un ion hydronium (OH3+) et un ion hydroxyde (OH–).
Il s’agit d’une réaction essentielle puisqu’elle est à l’origine de la notion de pH, une grandeur cruciale dans la mesure où elle régule les équilibres acido-basiques à tous les niveaux de l’organisation de la vie (que ce soit sur le plan d’un organisme ou sur le plan d’un biotope).
3 Des propriétés homogènes ?
On peut aller plus loin à partir de la notion de « spin », cette étrange propriété quantique qui désigne un comportement particulier affectant des particules élémentaires – une propriété difficile à décrire car elle n’a pas d’équivalent à notre échelle et que l’on décrit à défaut comme des types de rotation.
En termes techniques, le « spin » d’une particule décrit son moment cinétique intrinsèque ; de façon plus concrète, cette notion fut introduite afin d’expliquer l’interaction entre les particules de matière et les champs magnétiques.
Or, il faut savoir que l’atome d’hydrogène se comporte comme une particule du fait de sa structure simple ne comportant qu’un proton et un électron. Et un proton représente une particule élémentaire de spin ½, qui a donc la particularité de présenter deux sens de rotation possibles.
Par extension, cela affecte la molécule d’eau, car sa structure tripartite incluant deux atomes d’hydrogène la soumet à leurs comportements quantiques spécifiques. Il faut ainsi distinguer, selon les termes de la première quantification :
- l’eau de type « ortho » avec ses des atomes d’hydrogène qui « tournent » dans le même sens
- l’eau de type « para » avec ses atomes d’hydrogène qui « tournent » en sens contraire.
On doit parler ici d’isomères : deux molécules qui présentent la même formule mais révèlent des propriétés physiques, chimiques, thermodynamiques, cinétiques, spectroscopiques bien différentes.
Traditionnellement, la distinction entre eau « ortho » et eau « para » n’est valable qu’à l’état gazeux ; mais des études récentes ont montré qu’elle se maintenait à l’état liquide. Il en découle cette réalité étrange, souvent complètement ignorée, que l’eau gazeuse comme l’eau liquide doivent être considérées comme un mélange de deux substances bien distinctes.
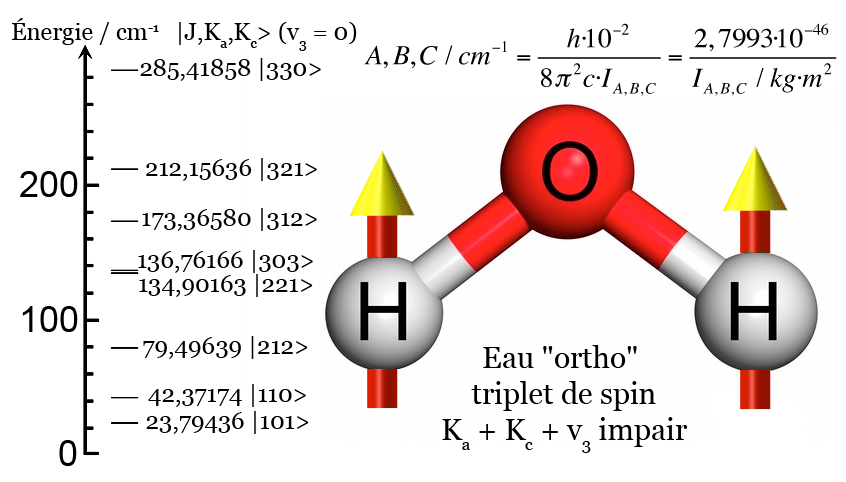
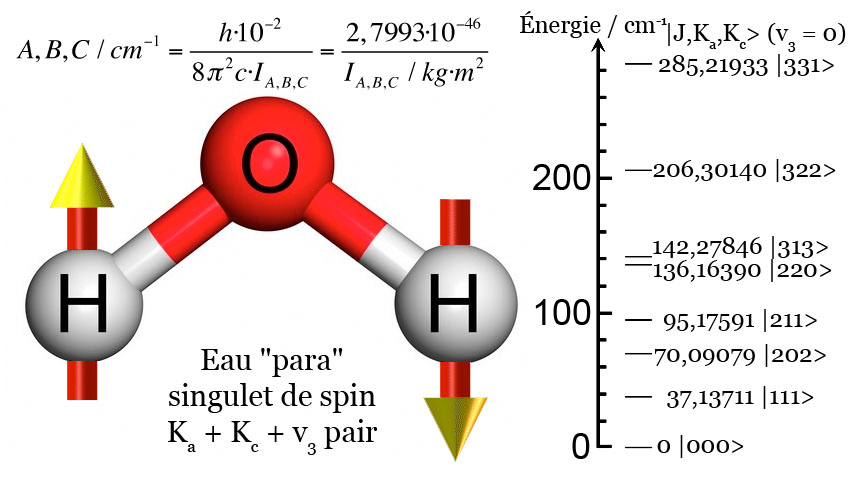
Sans rentrer dans des détails trop fastidieux, on peut ajouter que l’eau « ortho » est trois fois plus fréquente que l’eau « para », en raison des chances statistiques de l’obtenir ; et que l’eau « para », en raison des règles du spin, peut s’arrêter de tournoyer autour de son centre, à l’inverse de l’eau « ortho » condamnée à tournoyer sans fin.
Enfin, lors de l’application d’un champ magnétique comme dans le cas d’un scanner par résonance magnétique nucléaire du proton (RMN), seules les molécules « ortho » seront visibles, et non celles « para ». Ce qui invisibilise au moins un quart de l’eau corporelle dans ce type d’analyse.

4 L’eau un simple liquide ?

Parce que l’eau est le liquide le plus commun sur Terre, on ne s’interroge pas vraiment sur sa structure locale à l’échelle moléculaire en supposant que l’eau liquide fonctionne comme un assemblage dynamique d’entités H2O définissant l’expérience que l’on peut en faire – sa viscosité et sa fluidité.
Pourtant, les choses sont loin d’être si simples. En envoyant différents rayonnements sur l’eau liquide, il est possible d’étudier sa structure locale. Ainsi, par diffusion des rayons X, cette matière est apparue comme un milieu structuré avec des distances caractéristiques entre les atomes d’oxygène de la molécule H2O.
Cependant, deux pics à deux distances différentes émergent systématiquement :
- un pic à 0,45nm associé à un état liquide surnommé LDW (Low Density Water)
- et un pic à 0,35nm associé à un état surnommé HDW (High Density Water).
Ce sujet est l’aspect le plus discuté parmi les spécialistes, car une image très différente est obtenue par d’autres méthodes utilisant les rayons X.
Cependant, l’étude de l’eau par spectroscopie infrarouge ou par diffusion Raman corroborent l’existence de deux types de structures aqueuses à l’échelle moléculaire, associée à des différences d’énergie au niveau des liaisons hydrogènes – ces liaisons qui confèrent à l’eau liquide ses propriétés.
Également, une vision plus précise de ce phénomène apparaît lorsque l’on parvient à encapsuler de grands clusters d’eau dans des nano-capsules en polyoxo-molybdate qui révèlent :
- soit l’existence de structures tétraédriques parfaitement ordonnées d’une densité de 0,69g.cm-3
- soit des structures non-tétraédriques désordonnées d’une densité plus faible de 0,36g.cm-3

Il faut donc admettre le fait que l’eau liquide se comporte comme une matière janusienne en révélant deux visages bien distincts : elle est moins la résultante d’un unique comportement collectif de molécules qu’un mélange de deux liquides bien distincts, indiscernables pour nous, mais dotés de densités propres et qui présentent de façon locale, à l’échelle nanométrique, des structures et des dynamiques spécifiques.
Cette réalité d’une double composition de l’eau implique d’importantes conséquences, car ce qui pousse les molécules aqueuses à adopter la forme de deux liquides distincts n’est pas très clair. Les anomalies de l’eau reflètent les propriétés de la liaison hydrogène ; mais plus profondément, le pourquoi d’une telle liaison en premier lieu est le cœur de ce qui fait de l’eau une énigme, dont les propriétés sont loin d’avoir été toutes élucidées.
*
* *
Ce tour d’horizon de quelques aspects scientifiques de l’eau :
- l’existence d’un quatrième état jamais évoqué
- les nombreux isotopes de la molécule d’eau
- l’existence de deux isomères aux propriétés distinctes
- le fait que l’eau liquide soit composé de deux matières bien différentes
montre à quel point cette matière, considérée au premier regard comme une réalité bien connue et qui n’a plus rien à cacher, est d’une complexité déroutante.
Ces quelques éléments éclairent en retour pourquoi la recherche au sujet de l’eau se poursuit à haut niveau en chimie et en physique. Car les modèles qui peuvent expliquer de façon cohérente toutes ces propriétés et tous ces comportements obligent à se tourner vers des concepts de physique particulièrement avancés pour lesquels aucune donnée ne vient encore corroborer l’existence – notamment en raison de l’absence de techniques suffisamment performantes pour confirmer ou infirmer la réalité de ces modèles.
En retour, on comprend pourquoi l’essentiel du débat actuel sur certaines propriétés controversées de l’eau, en particulier sa mémoire pour reprendre le terme métaphorique que lui a donné Émile Benveniste, reste enlisé à un niveau souvent stérile. Car si l’on se représente l’eau comme un simple assemblage de molécules H2O toutes identiques, on ne peut comprendre comment des expériences aient pu mettre en lumière des propriétés qui invitent à suspendre la croyance que l’on a fait le tour de l’eau.
